Schrödinger Dalga Denklemi
1920 li yıllarda ışığın hem dalga hem de parçacık özelliğine sahip olduğu anlaşıldı. De Broglie madde dalgalarının tanımlanmasının ardından Erwin Schrödinger madde dalgasının dış kuvvetler altında nasıl değiştiğini tanımlayan denklemi formüle etti. Daha sonra zamandan bağımsız dalga fonksiyonu olarak düzenlenmiştir.
Klasik fizikte F=m.a denklemi ne ise kuantum mekaniğinde de Schrödinger denklemi odur. Temel olarak, olayların ya da olayların sonuçlarının dalga fonksiyonu cinsinden ifade edildiği bir eşitliktir.
Moleküler fizikteki modern araştırmalar, materyal bilimi ve nükleer fizik araştırmalarının neredeyse tamamı Schrödinger dalga denklemine dayanır. Schrödinger denklemi ile verilen dalga fonksiyonu bir sistem için mümkün olabilecek ihtimalleri gösterir. Bu ihtimal belirli bir uzaklığa kadar çok yüksek iken, bu uzaklıktan sonra neredeyse sıfır olur.
Örneğin bir hidrojen atomunun elektronu, herhangi bir anda atom çekirdeği ile sonsuz arasında herhangi bir yerde bulunabilir. Elektronun belirli bir anda bulunacağı yer ile bulunması muhtemel yerler aynı değildir.
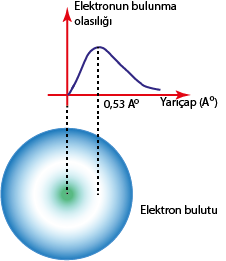
Deneysel olarak bir elektronun belirli bir anda belirli bir bölgede bulunmasının sonlu olasılığı vardır. Bu durumun olasılığı 0 ile 1 arasında bir değerdir. Örneğin bir elektronun belirli bir yarıçapta bulunma olasılığı 0,4 olsun. Bu değer, elektronun bu konumda olma olasılığının % 40 olduğu anlamına gelir.
Schrödinger denklemleri, elektronun belirli bir anda nerede olacağını değil, orada olma ihtimalinin ne olduğu bilgisini verir. Atom içinde hareket eden elektronların doğru konumundan söz etmek mümkün değil fakat bulunma ihtimalinin yüksek olduğu yerler tespit edilebilir. Elektronların bulunma ihtimalinin yüksek olduğu yerlere elektron bulutu adı verilir.
Hidrojen atomunun Bohr enerji seviyesindeki elektronun konumu birçok kere ölçülerek, yapılan ölçümler noktalar şeklinde belirlendiğinde elektron bulutuna benzer bir desen elde edilir. Farklı zamanlarda elektron bu desenin herhangi bir yerinde olabilir. Çok küçük de olsa anlık olarak elektronun çekirdek içinde olması ihtimali de vardır. Ancak elektronun, Bohr yarıçapı olarak tanımlanan uzaklıkta bulunma ihtimali daha fazladır.
Schrödinger dalga denkleminden sonra Bohr’un ifade ettiği, elektronların sınırlı bir bölgede hareket etmedikleri daha net olarak anlaşılmıştır.