Rutherford Atom Modeli
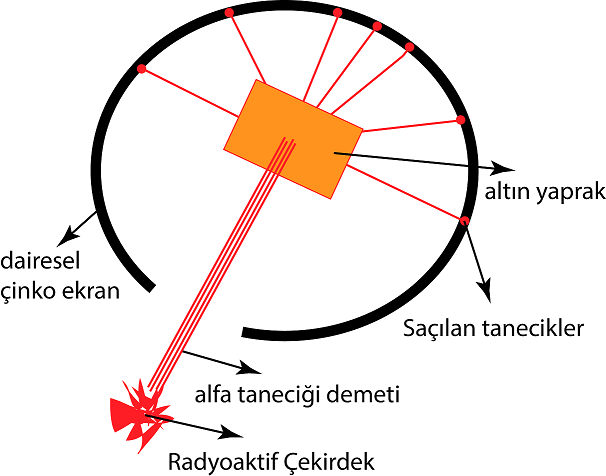
1918 yılında Rutherford, atom çekirdeğindeki pozitif yüklü bir parçacık olan protonu keşfetti. Rutherford şekildeki altın yapraklarını alfa tanecikleriyle bombardıman ettiği deney düzeneğini kurarak Thomson‘un atom modelinin yanlışlığını gösterdi.
Rutherford Güneş Sistemine Benzer Bir Atom Modeli Geliştirdi
Alfa tanecikleri ile yapılan deney, atomda büyük boşlukların olduğunu gösteriyordu. Rutherford, bir kısım alfa taneciklerinin saçılmasına ise, kütlesi oldukça büyük olan pozitif yüklerin neden olduğunu düşündü. Bu pozitif yüklerin bir merkezde toplu halde bulunduğunu anladı. Bunun üzerine Rutherford, resimdeki gibi Güneş sistemine benzeyen kendi atom modelini geliştirdi.
Rutherford Atom Modelinin Özellikleri
Rutherford’un ortaya koyduğu atom modelinin özelliklerini şu şekilde özetleyebiliriz:
– Atomda pozitif yükler çekirdekte toplanmıştır. Atomun kütlesinin büyük kısmıni çekirdek oluşturur.
– Atomda, çekirdek çok küçük yer kaplar. Atom, çekirdek dışında tamamen boşluktan ibarettir. Bu boşlukta elektronlar bulunur.
– Elektronlar, Thomson’un dediği gibi hareketsiz değildir. Böyle olsaydı, elektronların, elektriksel kuvvetten dolayı çekirdeğe yapışmaları gerekirdi. Elektronlar elektrostatik kuvvet etkisinde çekirdek çevresinde dönerler.
– Normal şartlarda elektronların negatif yük miktarı ile, çekirdekteki pozitif yük miktarı birbirine eşit olduğundan, atom nötrdür.
Rutherford Atom Modelinin Yetersizlikleri
Rutherford atom modeli ayrıntıları açıklamakta çok başarılı olmasa da, atomda özellikle yoğun pozitif yüklü bir çekirdeğin varlığını ortaya koyması bakımından önemlidir. Rutherford atom modeli iki önemli yetersızliği ile tenkit ediimiştir. Bu model, bazı fiziksel gerçeklere ters düşüyordu. Bunları şu şekilde özetleyebiliriz:
– Rutherford modelinde, elektronlar çekirdek çevresinde ivmeli hareket yapar. Elektromanyetik teoriye göre yüklü tanecikler ivmeli hareket yaparsa elektromanyetik ışıma yapmaları gerekir. Işıma yaparak enerjisi azalan elektronların yörüngelerinin ise, yapay uydular gibi gittikçe küçülmesi ve elektronların spiral çizerek çekirdek üzerine düşmeleri gerekirdi. Bunun sonucunda da atomun yapısının bozulması gerekirdi. Gerçekte ise, atomların kararlı bir şekilde var oldukları bilinmektedir.
– Elektromanyetik dalga yayarak çekirdeğe doğru yaklaşan ivmeli elektronun hızı ve dolayısıyla frekansının artması gerekir. Böylece, elektronun etrafa yaydığı dalgaların enerjisi de sürekli olarak artar ve bu atomdan sürekli bir spektrum elde edilir. Fakat yapılan araştırmalar göstermiştir ki, atomlardan elde edilen spektrumlar sürekli değil belirli enerji değerlerinde olabilmektedir. Bu olay atomların çizgi spektrumları ile açıklanır.